中日友好医院LDT自研髓系血液肿瘤57基因突变检测试剂、淋系白血病41基因突变检测试剂委托生产企业市场调研公告


为保证医院LDT临床检验与研究工作的顺利开展,依据北京市药品监督管理局《关于做好医疗机构白制试剂试点品种调整工作的通知》(京药监发〔2025〕44号)文件要求现就医院自行研制体外诊断试剂委托生产企业的情况进行公开市场调研,欢迎符合条件并有合作意向的企业积极报名参与。
一、公告概况:中日友好医院LDT自研髓系血液肿瘤57基因突变检测试剂、淋系白血病41基因突变检测试剂委托生产企业市场调研公告
二、项目内容
2.1项目名称:中日友好医院LDT自研髓系血液肿瘤57基因突变检测试剂、淋系白血病41基因突变检测试剂委托生产
2.2、项目编号:2025-DY-049
2.3、项目范围:中日友好医院
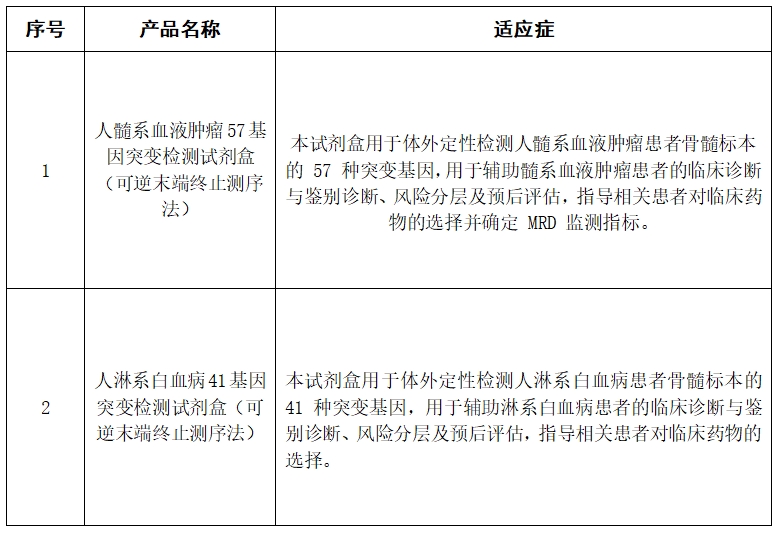
2.4、调研列表范围:
三、资格要求
3.1、具备医疗器械生产许可证且住所及生产地址为北京;
3.2、提供医疗器械生产许可证,明确生产范围覆盖IVD相关类别,需涵盖三类体外诊断试剂;
3.3、质量管理体系按照ISO13485《医疗器械质量管理体系用于法规的要求》运行;
3.4、生产、质量、技术负责人需具备相关专业背景(如生物医学、检验学)及3年以上行业经验;
3.5、生产环境要求:十万级洁净区、十万级洁净区+生物安全柜、万级洁净区、万级洁净区+生物安全柜;半成品中间品保存环境(-20℃±5℃、2~8℃);
3.6、设备要求:需具备配制、离心、震荡混匀、分装等工序需求设备;
3.7、人员要求:须具备有资质生产人员;
3.8、工艺要求:相关工艺文件齐全,能够指导人员操作,生产工艺流程按甲方要求进行生产;
3.9、检验项目:复核COA、外观、浓度、片段大小检测等操作;
3.10、质控条件:要求供应商对每个产品制定单独的产品工艺规程,对物料及产品质量标准进行了明确规定,产品质量标准符合产品技术要求,确保产品在可控的生产条件下进行生产,生产过程严格按照生产工艺规程进行,保证产品检测结果的准确性,所有的原辅料、包材等均需检测放行后,方可进行下一工序操作。
3.11、供应商质量管理体系应符合《医疗器械质量体系用于法规的要求》、《医疗器械生产质量规范》,定期接受中日友好医院和药监部门核查,提供质量管理方案。
3.12、生产周期及产品供应条件:生产周期小于14个工作日,收到订单后20个工作日内发货。
四、参与方式
4.1、有意参加此次市场调研的申请人,须将下述材料打包发送至联系人邮箱。所填写信息必须保证真实无误。
4.2、申请人须提供的材料:
(1)企业营业执照;
(2)医疗器械生产许可证;
(3)ISO13485医疗器械质量管理体系证书;
(4)调研信息表(见附件)。
注:申请人必须将上述资料打包在1个压缩包中,打包的压缩包名称须为“产品名称+申请人名称”,压缩包中设置4个文件,并按照上述规定的编号顺序在文件夹中列明,不符合上述要求的材料不予通过(申请人提供的材料超出上述范围的视为不符合)。
4.3、调研填报期限:2025年7月11日至2025年7月18日,五个工作日。逾期不予受理。
4.4、联系方式
项目联系人:游老师
电话:010-84206142
邮箱:zryhygc407@163.com


















